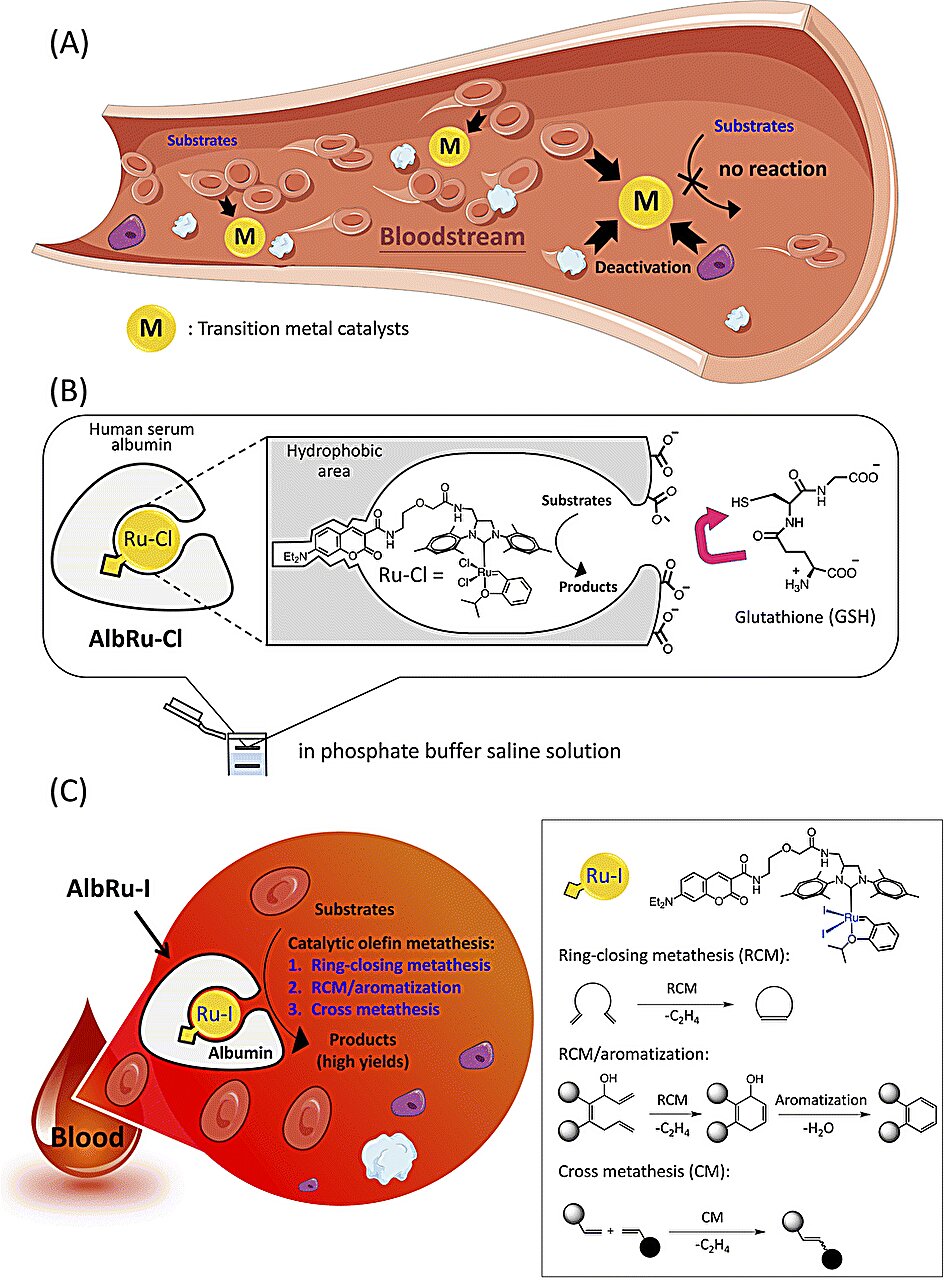
استبدال الأوليفين التحفيزي في الدم. (A) الشرط الأساسي لتطبيق التفاعلات المحفزة بالمعادن الانتقالية في الدم هو حماية نشاطها لتجنب التعطيل السريع بواسطة العديد من بروتينات المصل، والأيضات، وخلايا الدم. (ب) مجمع الروثينيوم Ru-Cl المغطى بألبومين المصل البشري لتشكيل إنزيم معدني صناعي متوافق حيوياً (ArM) (AlbRu-Cl). (C) يمكن لـ ArM (AlbRu –I) المحتوي على الألبومين (AlbRu –I) أن يحفز تفاعلات استبدال إغلاق الحلقة (RCM)، وتفاعلات RCM/التنكيه المتتابعة، وتفاعلات استبدال الأوليفين المتقاطع (CM) في الدم.
Credit: Chemical Science (2023). DOI: 10.1039/D3SC03785A
في الأدوية التقليدية التي يتم تناولها عن طريق الحقن أو الحبوب، يدور جزيء الدواء النشط في جميع أنحاء الجسم، ولا يغمر الموقع المستهدف فحسب، بل أيضًا الأنسجة السليمة. يمكن أن تكون الآثار الجانبية الناتجة خطيرة جدًا لدرجة أنها يمكن أن تسبب ضررًا دائمًا وتجبر على إيقاف العلاج .
إن تجميع جزيئات الدواء في المواقع المستهدفة داخل الجسم يمكن أن يجعلها أكثر فعالية مع تقليل آثارها الجانبية.
يقول كاتسونوري تاناكا، كبير العلماء في مختبر الكيمياء الاصطناعية الحيوية RIKEN: "إن التركيب المباشر للأدوية في الجسم من شأنه أن يمكّن الأدوية من علاج الأمراض دون التسبب في آثار جانبية في الأنسجة السليمة". "لهذا السبب نحتاج إلى نظام تحفيز حيوي متوافق حيويًا لإجراء تخليق الدواء بالقرب من المواقع المستهدفة في الجسم."
استهدف الفريق تجميع الأدوية في الجسم باستخدام تفاعل كيميائي محفز يسمى استبدال الأوليفين. يشرح تاناكا قائلاً: "يعد استبدال الأوليفين أحد أكثر الطرق فعالية لبناء روابط ثنائية بين الكربون والكربون لتصنيع الأدوية". "إذا كان من الممكن العمل بها في الجسم، فمن المفترض أن تمكننا من تصنيع العديد من أنواع الأدوية المختلفة."
يتم إبطال مفعول معظم المحفزات الكيميائية بسرعة بواسطة الجزيئات الحيوية الموجودة في مجرى الدم. للتغلب على هذه المشكلة، قام الفريق بتغليف محفز استبدال الأوليفين القائم على الروثينيوم داخل بروتين وقائي يسمى ألبومين المصل البشري.
كان فريق تاناكا قد أظهر سابقًا أن مركب كلوريد الروثينيوم الموجود داخل ألبومين المصل البشري - والذي يشكل مجموعة محفزة تسمى الإنزيم المعدني الاصطناعي - كان نشطًا إلى حد ما في الدم . لقد أظهروا الآن أن التحول إلى مركب يوديد الروثينيوم ينتج إنزيمًا معدنيًا صناعيًا متفوقًا بكثير.
عند تركيزات محفز منخفضة، قام محفز يوديد الروثينيوم (AlbRuI) الجديد القائم على الألبومين بتحفيز ثلاثة أنواع من تفاعلات استبدال الأوليفين في الدم بإنتاجية عالية.
يقول تاناكا: "أظهر AlbRuI أيضًا ثباتًا قويًا لمدة 24 ساعة في الدم". "هذا يوسع التوافق الحيوي للإنزيمات المعدنية الاصطناعية ويفتح الباب لتطوير الإنزيمات المعدنية الاصطناعية العامة القائمة على المعادن للتفاعلات التحفيزية في الدم ."
وأظهر الفريق أيضًا أن جرعة منخفضة من AlbRuI الذي يستهدف السرطان أعاق بشكل كبير نمو الورم في الفئران من خلال التوليف الموضعي لعقار مضاد للورم.
يعتزم الفريق توسيع استخدام المحفز الخاص به . يقول تاناكا: "نأمل في استخدام AlbRuI لتجميع مجموعة متنوعة من الجزيئات النشطة بيولوجيًا". "وبعد ذلك يمكننا استخدامه ليس فقط لعلاج السرطان ولكن أيضًا لعلاج أمراض أخرى دون آثار جانبية."
المصدر :